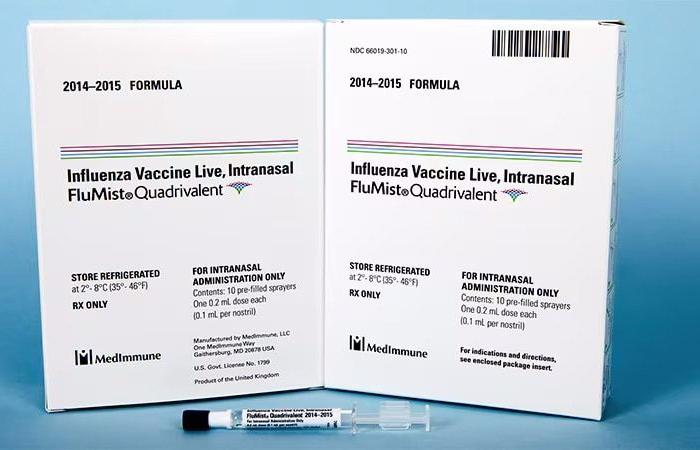
MILANO – IL Food and Drug Administration americana (FDA) ha dato il via libera alla somministrazione del vaccino antinfluenzale FluMist spray nasale a domicilio da parte del paziente o di una persona cara, senza l’intervento di un operatore sanitario[1].
Questo vaccino, FluMist, è stato inizialmente approvato dalla FDA nel 2003 per l’uso in persone di età compresa tra 5 e 49 anni e nel 2007 la FDA ha approvato l’uso di FluMist per bambini di età compresa tra 2 e 5 anni.
Ora è il primo vaccino antinfluenzale che può essere somministrato senza l’intervento di un operatore sanitario e il produttore spera che possa migliorare l’accesso alla vaccinazione antinfluenzale.
FluMist contiene una versione indebolita del virus dell’influenza e richiede la somministrazione una volta all’anno.
FluMist protegge da due tipi comuni di virus influenzali, A e B, ed è adatto a chiunque di età compresa tra 2 e 49 anni.
Gli studi hanno dimostrato che le persone di età compresa tra 18 e 49 anni possono somministrare con successo il vaccino con la stessa efficacia di un medico o di un infermiere, secondo MedImmune, la filiale di AstraZeneca che produce FluMist [2].
Pietro Marchiche dirige il Centro per la valutazione e la ricerca biologica (Centro per la valutazione e la ricerca biologica) della FDA, ha affermato che l’autorizzazione offre opzioni più convenienti per le persone che cercano protezione contro l’influenza.
Le persone che desiderano utilizzare FluMist a casa avranno comunque bisogno di una prescrizione. Tuttavia, il vaccino sarà presto disponibile tramite una farmacia online.
AstraZeneca ha affermato che, dopo aver seguito un processo per confermare la loro idoneità, i pazienti riceveranno la prescrizione e riceveranno il FluMist direttamente a casa loro, insieme a istruzioni dettagliate su come conservarlo e utilizzarlo.
FluMist rimarrà disponibile anche negli studi medici e nelle farmacie.
Per i bambini dai 2 ai 17 anni, la FDA raccomanda che lo spray sia somministrato da un genitore o da chi si prende cura di loro. Gli effetti collaterali più comuni includono naso che cola o naso chiuso, febbre nei bambini piccoli e mal di gola negli adulti.
Disponibile in Francia?
FluMist Quadrivalent è identico al vaccino Fluenz Tetra che ad oggi non è più commercializzato in Francia.
Si noti che l’indicazione europea per Fluenz Tetra (2-18 anni) è più ristretta di quella degli Stati Uniti (2-49 anni).
Chiesto da Medscape edizione francese sulla disponibilità del vaccino, il laboratorio AstraZeneca ha sottolineato che il vaccino è “già disponibile da anni nella sua forma tetravalente in diversi Paesi europei” e che “i suoi benefici per l’accettabilità e quindi l’efficacia della vaccinazione infantile sono stati dimostrati, in particolare nei nel Regno Unito dove è ampiamente utilizzato” e che protegge anche indirettamente la popolazione vulnerabile. “In Francia è attualmente in fase di valutazione da parte dell’HAS, che lo aveva raccomandato in via preferenziale nel 2022, nonostante la sua assenza in Francia.”
Il laboratorio spera di poter portare a termine le discussioni [sur le prix] il più rapidamente possibile per consentirne l’utilizzo in Francia in un arco di tempo compatibile con la prossima stagione epidemica. «Gli ordini devono infatti essere effettuati almeno 6 mesi prima dell’inizio della produzione, tenendo conto della domanda e delle scadenze di produzione incomprimibili», precisa AstraZeneca.
Questo articolo è stato tradotto da Medscape.com utilizzando più strumenti editoriali, inclusa l’intelligenza artificiale, nel processo. Il contenuto è stato visionato dalla redazione prima della pubblicazione.