⇧ [VIDÉO] Potrebbero piacerti anche questi contenuti dei partner
I ricercatori hanno identificato due molecole la cui interazione aumenta significativamente la diffusione della proteina tossica alfa-sinucleina nei neuroni, una caratteristica chiave della malattia di Parkinson. Prenderne di mira uno con un farmaco antitumorale approvato dalla FDA inibirebbe questa interazione, portando a una riduzione significativa della quantità della proteina alfa-sinucleina. Il farmaco potrebbe quindi costituire un’opzione promettente per rallentare la progressione della malattia.
Colpendo quasi 8,5 milioni di persone in tutto il mondo, il Parkinson è la seconda malattia neurodegenerativa più comune, dopo l’Alzheimer. Si manifesta con disturbi progressivi del movimento (tremori, rigidità, problemi di equilibrio, difficoltà di parola, ecc.) nonché con disturbi dell’umore e delle funzioni cognitive. Questi sintomi sono dovuti all’eccessivo accumulo di proteine alfa-sinucleina mal ripiegate nei neuroni e nelle cellule gliali.
Mentre l’alfa-sinucleina solubile è essenziale per la comunicazione sinaptica, l’alfa-sinucleina mal ripiegata è una forma tossica che si diffonde gradualmente dal sistema nervoso enterico e periferico al sistema nervoso centrale. Il suo accumulo induce una forma di morte programmata (processo chiamato “parthanatos”) dei neuroni dopaminergici, che provoca i sintomi tipici della malattia.
La diffusione dell’alfa-sinucleina patologica è quindi considerata un meccanismo essenziale per la patogenicità della malattia. Questo processo avviene attraverso i recettori della superficie cellulare che mediano sia la sua propagazione tra i neuroni sia il suo assorbimento da parte di essi. Tra questi recettori c’è, ad esempio, il gene di attivazione dei linfociti 3 (Lag3).
Studi precedenti hanno dimostrato che la sua eliminazione riduce significativamente l’assorbimento dell’alfa-sinucleina tossica da parte dei neuroni, senza fermarlo. Ciò suggerisce che altri recettori potrebbero essere parzialmente coinvolti nella diffusione e nell’assorbimento della proteina.
Il team del nuovo studio suggerisce che potrebbe trattarsi della proteina precursore della beta-amiloide di tipo 1 (Aplp1). Infatti, è stato dimostrato in particolare che questa proteina si lega specificamente all’alfa-sinucleina patologica ed è associata alla neurodegenerazione. Tuttavia, il suo coinvolgimento nella propagazione dell’alfa-sinucleina era precedentemente inesplorato.
« Il nostro lavoro aveva precedentemente dimostrato che Lag3 non è l’unica proteina della superficie cellulare che aiuta i neuroni ad assorbire l’alfa-sinucleina. Ci siamo quindi rivolti ad Aplp1 nei nostri esperimenti più recenti », spiega in un comunicato stampa la co-autrice principale del nuovo studio, Valina Dawson, della Johns Hopkins University (negli Stati Uniti). Allo studio hanno partecipato anche ricercatori della Nagaoka University of Technology (Giappone), dell’Università di Heidelberg (Germania), dell’Università di Pittsburgh e dell’Accademia cinese delle scienze.
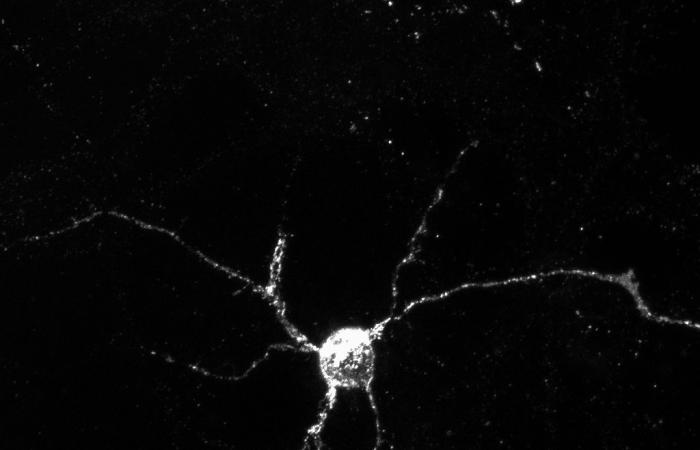
Panoramica dei neuroni che esprimono Aplp1 (bianca), una proteina chiave che consente alle cellule cerebrali di assorbire l’alfa-sinucleina, che causa la malattia di Parkinson. ©Yasuyoshi Kimura
Una riduzione del 90% nell’assorbimento delle proteine tossiche
Per supportare la loro ipotesi, i ricercatori hanno selezionato topi transgenici privi di Aplp1 o Lag3, o di entrambi. Hanno scoperto che la cancellazione di Aplp1 riduceva significativamente l’assorbimento dell’alfa-sinucleina tossica e la sua trasmissione da neurone a neurone. Anche i deficit comportamentali sono risultati ridotti nei topi privi del recettore. Un effetto simile è stato osservato nei topi privi di Lag3.
Tuttavia, l’effetto è stato ancora maggiore nei topi privi di entrambi i recettori. L’assorbimento cellulare della proteina dannosa alfa-sinucleina è diminuito del 90%, mentre la perdita di neuroni della dopamina e i deficit comportamentali erano quasi inesistenti. Ciò suggerisce che l’interazione tra le due proteine gioca un ruolo chiave nella progressione della malattia. Il legame di Aplp1 con Lag3 sulla superficie dei neuroni consentirebbe loro di assorbire in modo massiccio l’alfa-sinucleina tossica circolante nello spazio intercellulare, il che porterebbe alla parthanatos.


Aplp1 e Lag3 interagiscono tra loro. (a) Lag3 inibisce Aplp1 mediante immunoprecipitazione anti-Lag3 410C9 nei lisati cerebrali di topo WT, ma non nei lisati Lag3–/–. (b) Aplp1 inibisce Lag3 mediante immunoprecipitazione anti-Aplp1 CT11 nei lisati cerebrali di topo WT, ma non nei lisati Aplp1–/–. (c, d) Mappatura dei domini leganti Lag3 in Aplp1. (e) Mappatura dei domini leganti Aplp1 in Lag3. Gli esperimenti in (a–e) sono stati ripetuti tre volte indipendentemente con risultati simili. (f-h) Identificazione dell’interfaccia di A1E1 (dominio E1 di APLP1) che si lega a L3D2 (dominio D2 di LAG3). © Xiaobo Mao et al.
Un farmaco che potrebbe colpire una serie di malattie neurodegenerative
I ricercatori hanno dedotto che questa interazione potrebbe essere un obiettivo potenzialmente promettente per il trattamento della malattia. Nivolumab/relatlimab, un anticorpo anti-Lag3 approvato nel 2022 dalla FDA per il trattamento del melanoma, potrebbe inibire questa interazione.
Vedi anche


Iniettando il farmaco in topi non geneticamente modificati (cioè dotati di recettori Aplp1 e Lag3), il farmaco ha inibito efficacemente la diffusione e l’assorbimento dell’alfa-sinucleina mal ripiegata. Questo effetto è stato ulteriormente maggiore di quello della delezione genetica di Lag3, a causa della stretta associazione tra i due recettori.
Questi risultati suggeriscono che il farmaco potrebbe essere utilizzato sia come trattamento per il morbo di Parkinson che per altre malattie neurodegenerative che coinvolgono il recettore Aplp1, come l’Alzheimer. “ I nostri risultati suggeriscono che mirare a questa interazione con i farmaci potrebbe rallentare significativamente la progressione del morbo di Parkinson e di altre malattie neurodegenerative “, afferma il coautore dello studio Xiaobo Mao, anche lui della Johns Hopkins University.
D’altro canto, dato che anche l’Alzheimer è caratterizzato dall’interazione della proteina tau con il recettore Lag3, sarebbe logicamente possibile trattarlo con lo stesso anticorpo anti-Lag3. Come passo successivo, i ricercatori intendono valutare l’efficacia di nivolumab/relatlimab in modelli murini delle due patologie. I risultati dello studio sono pubblicati sulla rivista Comunicazioni sulla natura.