I lipidi dell’ambiente marino sono promettenti contro il cancro. Alcuni, come gli acidi grassi omega-3 presenti in alimenti come il pesce grasso, potrebbero agire come prevenzione. Altri sono fonti di ispirazione per lo sviluppo di molecole terapeutiche.
L’ambiente marino rappresenta una grandissima diversità non sfruttata di flora e fauna, e quindi un’alta probabilità di scoperta di nuove molecole a fini terapeutici. Comprende in particolare molecole che hanno mostrato un forte potenziale antitumorale.
Potremmo citare la citarabina ispirata alle molecole di una spugna caraibica (Cryptotethya cripta) e utilizzata in alcune forme di leucemia o, nel caso dei lipidi di origine marina, la miltefosina (che è indicata nel trattamento delle metastasi cutanee da cancro al seno).
L’ambiente marino è la principale fonte di lipidi (comunemente chiamati “grassi”) noti per i loro effetti inibitori sullo sviluppo dei tumori. Questi lipidi di origine marina possono essere utilizzati secondo due approcci complementari. Il primo approccio è nutrizionale, in particolare con il cibo. Il secondo approccio si basa sullo sviluppo di agenti lipidici antitumorali le cui strutture molecolari provengono o si ispirano all’ambiente marino.
Mirare alle cellule tumorali o all’ambiente tumorale
Qualunque sia l’approccio, questi lipidi di origine marina agiranno su bersagli specifici delle cellule tumorali o del microambiente tumorale. L’obiettivo è quello di intervenire globalmente sull’intero organismo del malato nonché sul tumore stesso per prevenire o inibire la crescita tumorale, sensibilizzare le cellule tumorali ai trattamenti antitumorali (chemioterapia, radioterapia e immunoterapia) e rallentare la denutrizione legato al cancro.
Influenzando alcune fasi dello sviluppo e della progressione dei tumori, i fattori dietetici ne stimolano o inibiscono la formazione. Pertanto, la comparsa di diversi tipi di cancro potrebbe essere ritardata se l’assunzione nella dieta di componenti alimentari che stimolano lo sviluppo del tumore fosse limitata o, al contrario, se fossero forniti fattori con attività inibitoria.
Sardine, sgombri e altri pesci grassi, fonti marine di omega-3
I lipidi di origine marina includono:
– acidi grassi polinsaturi omega-3 forniti dagli alimenti. Sono presenti nei pesci grassi come le sardine, sgombro e aringhe.
– lipidi eterei presenti ad esempio nell’olio di fegato di squalo e nelle capesante.
Questi diversi tipi di lipidi (acidi grassi polinsaturi dei fosfolipidi e dei lipidi eterei) sono costituenti delle membrane cellulari, in particolare delle cellule tumorali. Nelle cellule tumorali questi lipidi e i loro derivati possono agire anche sulla trasmissione dei segnali coinvolti nello sviluppo del tumore.
I meccanismi molecolari e cellulari attraverso i quali questi lipidi agiscono sullo sviluppo del tumore, sulla crescita, sulla migrazione e sull’invasione delle cellule tumorali, nonché la risposta ai trattamenti sono attualmente oggetto di studio, in particolare nella nostra unità di ricerca congiunta Inserm – Università di Tours, UMR 1069 “ Nicchia, nutrizione, cancro e metabolismo Ossidativo (N2COx)”.
Cancro al seno, cancro alla prostata, leucemia: acidi grassi antitumorali
Negli ultimi anni abbiamo identificato diversi lipidi o classi di lipidi di origine marina che esercitano attività anti o pro-tumorali. Questi lipidi agiscono sulla cellula tumorale incorporandosi nelle membrane dove si trovano le proteine bersaglio di questi lipidi (in particolare i canali ionici).
Nel cancro alla prostata abbiamo identificato, tra questi lipidi, gli omega-3 (come l’EPA o l’acido eicosapentaenoico) la cui presenza è associata ad una minore aggressività del cancro alla prostata.
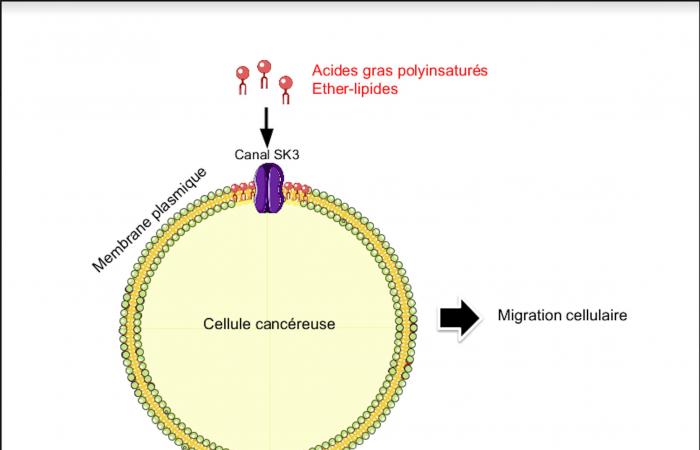
Nelle cellule tumorali, l’EPA omega-3 blocca un processo complesso che coinvolge un canale chiamato canale SK3. Tuttavia, il canale SK3 favorisce, tra le altre cose, la migrazione delle cellule tumorali, migrazione che è responsabile della loro aggressività e dello sviluppo di metastasi.
Allo stesso modo, nel cancro al seno, basse concentrazioni di questo EPA omega-3 ma anche di un altro omega-3 soprannominato DHA (per acido docosaesaenoico) sono associate a situazioni cliniche più aggressive come il cancro al seno multifocale (che corrisponde alla presenza di più tumori nella stesso seno), cancro al seno infiammatorio o cancro al seno con metastasi ossee nelle donne in premenopausa.
Nel caso della leucemia abbiamo anche dimostrato che gli omega-3 DHA ed EPA esercitano attività antileucemica. Ciò ha portato a un protocollo clinico in più centri di ricerca che mostra che questi acidi grassi possono essere somministrati in modo sicuro a pazienti di nuova diagnosi leucemia ad alto rischio, senza compromettere la chemioterapia.
Inoltre, il lavoro sugli animali, che deve essere confermato sugli esseri umani, suggerisce che gli omega-3 potrebbero anche ritardare la denutrizione indotta dal cancro.
Nei tre tipi di cancro citati, la presenza degli omega-3 EPA e DHA è associata a tumori meno aggressivi perché questi lipidi esercitano un’azione antitumorale.
Domani, integrazione di omega-3 per integrare i trattamenti?
L’impatto di questi omega-3 resta da esplorare a livello molecolare. Ma questo suggerisce il punto centrale dell’integrazione nutrizionale prevenzione tumori. È in questo contesto che il nostro team ha dimostrato che l’integrazione alimentare con omega-3 DHA durante la chemioterapia aumenta la sopravvivenza delle persone affette da cancro al seno metastatico.
Abbiamo inoltre individuato categorie di lipidi prodotti dall’organismo (lipidi alchileteri e lipidi alchenilici o plasmalogeni) per i quali è generalmente accettato che siano presenti in quantità maggiori. quantità nei tumori che nei tessuti non tumorali. Questi lipidi sono contenuti nelle membrane delle cellule, accanto al canale SK3, di cui abbiamo già parlato, che svolge un ruolo nella migrazione delle cellule tumorali.
Recentemente abbiamo descritto per la prima volta in dettaglio il ruolo di queste due classi di lipidi endogeni. I lipidi alchenilici limitano l’aggressività delle cellule tumorali (bloccando l’attività del canale SK3) mentre i lipidi alchilici esercitano un’azione opposta (attivando il canale SK3).
Questo lavoro fornisce quindi strade per combattere la progressione delle cellule tumorali che contengono queste due classi di lipidi endogeni in quantità maggiori rispetto ai tessuti sani.
Ciò comporterebbe privilegiare la categoria dei lipidi (lipidi alchenilici) che limita l’aggressività delle cellule tumorali. Questi lipidi, presenti nei frutti di mare, potrebbero infine essere prodotti sinteticamente per essere inclusi nella composizione di farmaci curativi.
Anche gli eterelipidi sintetici come Ohmline hanno mostrato il loro interesse terapeutico. Infatti, le modalità d’azione di questo lipide appena commercializzato dalla società Lifesome Therapeutics consentono di ridurre lo sviluppo di metastasi e di modificare la risposta agli anticorpi terapeutici (detti anche anticorpi monoclonali). Questo lipide sintetico riduce l’attività del canale SK3 coinvolto nella migrazione delle cellule tumorali.
Questo lipide è stato quindi proposto come coadiuvante della chemioterapia nella prevenzione delle neuropatie (si tratta del dolore localizzato in alcuni nervi) indotte da alcune chemioterapie.
Aumentare il potenziale dei frutti di mare contro il cancro
Si crea così un continuum che va dai modelli offerti dai prodotti marini alle applicazioni terapeutiche contro il cancro.
Questa ricerca, che fa parte della ricerca della rete “Molecole marine, metabolismo e cancro del centro oncologico Grand-Ouest”, dovrebbe aumentare il potenziale già riconosciuto dei frutti di mare nel campo del cancro e consentire di offrirli per la prevenzione nonché per sviluppare nuovi approcci terapeutici.
E disponiamo già di dati molto incoraggianti nella prevenzione dei tumori da parte delle diverse famiglie di lipidi di origine marina o sintetica che possono essere proposti come agenti di sensibilizzazione per chemioterapia, radioterapia e anticorpi terapeutici.
Questo articolo è il risultato di una ricerca condotta dall’intero team di Niche Nutrition Cancer & Oxidative Metabolism (N2COx) dell’Università di Tours.